بخش ها
- ویژگی های اساسی لیتیوم
- دامنه کاربرد
- بازیافت وسایل الکترونیکی
- استخراج و به دست آوردن لیتیوم
- بازیافت باتری ها و بازیابی لیتیوم
- نتیجه گیری
ویژگی های اساسی لیتیوم
نام فلز لیتیوم (از یونانی λίθoς -ου، “سنگ”) از این واقعیت ناشی می شود که برای اولین بار در یک ماده معدنی یافت شد، در حالی که بقیه مواد معدنی قلیایی در مواد گیاهی کشف شدند. این یوهان آرفودسون در سال 1817 بود که عنصر جدید اسپودومن و لپیدولیت را از یک معدن گلبرگ به نام LiAl(Si 2 O 5 ) 2 در جزیره لا اوتو (سوئد) یافت.
در سال 1818، CG Gmelin اولین کسی بود که مشاهده کرد که نمک های لیتیوم شعله را به رنگ قرمز روشن تبدیل می کند. هر دو موفق نشدند عنصر را از نمک های خود جدا کنند، کاری که WT Brande و Sir Humphrey Davy در نهایت با استفاده از الکترولیز اکسید لیتیوم موفق به انجام آن شدند.
در سال 1923 شرکت آلمانی Metallgesellschaft AG شروع به تولید آن با استفاده از الکترولیز کلرید لیتیوم مذاب و کلرید پتاسیم کرد.
لیتیوم (Li) سبک ترین فلز است که چگالی آن نصف آب است. مانند سایر فلزات قلیایی، تک ظرفیتی و بسیار واکنش پذیر است، اگرچه کمتر از سدیم است.
بنابراین، آزادانه در طبیعت یافت نمی شود. این یک عنصر نسبتا فراوان است. در پوسته زمین با ppm 65 وجود دارد که آن را در زیر Ni، Cu و W و بالای کروم و قلع قرار می دهد.
در کنار H و He، لیتیوم یکی از تنها عناصری است که برای اولین بار در طول انفجار بزرگ تولید شد. بقیه در طی همجوشی هسته ای در زمان تشکیل اولین ستارگان یا در طی انفجارهای ابرنواختری ایجاد شدند.
دارای خصوصیات شیمیایی فیزیکی اساسی زیر است:
چگالی : 535 کیلوگرم بر متر 3
سختی : 0.6
ظاهر : نقره ای سفید جامد , خاکستری جرم اتمی
: 6.941
شعاع اتمی : 167 pm
حالت اکسیداسیون : پایه قوی
ساختار بلوری : بدنه مکعبی مرکز
ذوب K 694
نقطه ذوب 694 K3
. گرما: 3582J/(Kg.K)
دامنه کاربرد
لیتیوم به دلیل نقش اصلی که ایفا می کند و به طور پیش بینی شده در چشم انداز انرژی در آینده ایفا خواهد کرد، به عنوان «روغن سفید» شناخته می شود. خواص آن باعث میشود یونهای لیتیوم به مادهای عالی برای تولید باتریها تبدیل شوند.
به دلیل گرمای ویژه بالا در کاربردهای انتقال حرارت کاربرد دارد و به دلیل پتانسیل الکتروشیمیایی بالا آند مناسبی برای باتری خودروهای برقی، گوشی های هوشمند و برخی وسایل الکترونیکی می باشد.
موارد زیر نیز ذکر شده است، اگرچه مصرف آنها نسبت به باتری های فوق الذکر نسبتاً کم است:
- نمک های لیتیوم، به ویژه کربنات لیتیوم (Li 2 CO 3 ) و لیتیم سیترات، در درمان شیدایی و افسردگی دوقطبی استفاده می شوند، اگرچه اخیراً استفاده از آن به افسردگی تک قطبی نیز گسترش یافته است. تثبیت کننده خلق و خو است. تصور می شود که اثرات آن بر اساس اثرات فعال آن بر عملکرد سروتونین انسانی باشد. علاوه بر این، در پلاسمای خون و/یا در گلبول های قرمز حل شده است.
- کلرید و لیتیوم بروماید رطوبت سنجی بالایی دارند، بنابراین عوامل خشک کننده عالی هستند. دومی در پمپ های جذب حرارت، در میان ترکیبات دیگر مانند نیترات لیتیوم استفاده می شود.
- لیتیوم استئارات یک روان کننده عمومی است که در کاربردهای دمای بالا استفاده می شود.
- لیتیوم عاملی است که در سنتز ترکیبات آلی استفاده می شود.
- هیدروکسید لیتیوم در فضاپیماها و زیردریایی ها برای تصفیه هوا با استخراج دی اکسید کربن استفاده می شود.
- این بخشی از آلیاژهای آلومینیوم، کادمیوم، مس و منگنز است که در صنعت هوانوردی استفاده می شود و با موفقیت در ساخت سرامیک ها و عدسی ها مانند تلسکوپ با قطر 5.08 متر در مونت پالومار استفاده شده است.
- کاربردهای هسته ای نیز دارد. لیتیوم دارای دو ایزوتوپ پایدار است: Li-6 و Li-7 که دومین ایزوتوپ فراوانترین (92.5%) است.
هر ساله 800000 تن باتری خودرو، 190000 تن باتری صنعتی و 160000 تن باتری از کالاهای مصرفی الکترونیکی وارد بازارهای اتحادیه اروپا می شود. این باتری ها در داخل آرایش خود حاوی لیتیوم و سایر فلزات با ارزش مانند کبالت، مس و غیره هستند.
در مقیاس جهانی، تخمین زده میشود که بازار باتریهای لیتیوم یونی در سال 2022 حدود 46.21 میلیارد دلار درآمد ایجاد کند. پیش بینی می شود تا سال 2020 64 درصد افزایش یابد.
مشکلاتی از اثرات زیست محیطی در هنگام استخراج این ماده معدنی وجود دارد، مانند آلودگی آب، تأثیرات بر روستاها، تأثیرات روی گیاهان و جانوران و تولید زباله های جامد و شیمیایی.
آرژانتین در مورد این سوالات بسیار نگران است، زیرا مقامات تایید کرده اند که این کشور تولید لیتیوم را در سال 2019 سه برابر خواهد کرد. انتظار می رود که تا سال 2025، تولید لیتیوم حدود 400000 تا 500000 تن باشد.
بازیافت وسایل الکترونیکی
امروزه به دلیل افزایش سریع مصرف این محصولات، پردازش و بازیافت زباله هایی که از وسایل الکتریکی و الکترونیکی مانند رایانه، تلویزیون، یخچال و تلفن همراه به دست می آیند، بیش از هر زمان دیگری اهمیت پیدا کرده است.
اروپا دومین منطقه در جهان بود که در سال 2016 با 12.3 میلیون تن (MT) بیشترین زباله الکترونیکی را تولید کرد، پس از آسیا که 18.2 تن تولید کرد. با وجود تمام قوانین فعلی، گزارش ها نشان می دهد که تنها 8.9 تن زباله الکترونیکی در سراسر جهان جمع آوری و بازیافت می شود. این معادل 20 درصد از کل زباله های الکترونیکی تولید شده است.
بر اساس منابع موثق، 80 درصد از زباله های فناوری تولید شده توسط جهان اول به آفریقا فرستاده می شود، هم برای تامین تجارت این محصولات با واحدهای دست دوم، اغلب منسوخ و با عمر بسیار کوتاه و هم برای تغذیه بازیافت غیرقانونی. زنجیر.
در حقیقت، فلزاتی مانند وانادیم، کبالت، آرسنیک، آلومینیوم، کروم، سرب و غیره در نمونههای خونی که از مهاجران آفریقایی آنالیز شده بود یافت شدهاند که از مقادیر به دست آمده از افرادی از کشورهای پیشرفتهتر مانند ژاپن فراتر رفته است. یا آمریکا
نویسندگان واقعیت دیگری را برجسته میکنند: آفریقا ممکن است در خطوط ثابت از سایر نقاط جهان عقب باشد، اما استفاده از تلفن همراه در سالهای اخیر در کشورهای آن چه در شهرها و چه در مناطق روستایی به شدت افزایش یافته است و ۹۷ درصد از تلفنهای همراه دست دوم هستند.
بنابراین، نظارت بهتر بر این نوع آلایندهها توصیه میشود، زیرا برخی از این عناصر خطر زیادی برای سلامتی دارند و به خوبی شناخته شده است که آلودگی مرزها را رعایت نمیکند.
بنابراین، مدیریت نادرست این زبالههای فناوری در آن کشورها میتواند باعث افزایش کلی آلودگی در سراسر جهان شود.
هنگام بازیافت باتری های لیتیوم، لیتیوم موجود در آنها دور ریخته می شود. این ممکن است ناسازگار به نظر برسد، اما از نظر اقتصادی اینطور نیست، زیرا قیمت لیتیوم حدود 6 یورو در هر کیلوگرم است، به اندازهای پایین که هیچ تلاش خصوصی به نفع بازیافت وجود ندارد.
در حال حاضر، وقتی باتریهای لیتیومی خود را برای بازیافت میفرستیم، فلزاتی که از آنها استخراج میشود، مانند کبالت، ارزشمندترین هستند. کبالت در باتریهای لیتیوم یونی استفاده میشود که سپس بهصورت اکسید کبالت و لیتیوم از آن استخراج میشود، با قیمت هر کیلو ۱۹ یورو، بیش از سه برابر قیمت در بازار لیتیوم.
با توجه به قیمت پایین لیتیوم که انتظار میرود به لطف ذخایر جدید یافت شده در بولیوی ثابت بماند، بازیابی باتریهای مستعمل آن هیچ انگیزه تجاری ندارد و آن را به عنوان یک پرکننده ساده برای بتن میگذارد و در نتیجه از بازیابی و استفاده آینده آن جلوگیری میکند. .
با این حال، این مستلزم خطراتی است، زیرا باتری ها حاوی اسیدها و مواد قلیایی هستند که در طول کار خود به عنوان الکترولیت عمل می کنند. هیچ کس نمی تواند اطمینان دهد که پس از دفن شدن باتری ها، آبشویی داخلی (انحلال) وجود ندارد و ممکن است بتن را خورده کند، زیرا این ماده ممکن است در معرض نشتی و شکستگی در اثر لرزش یا زلزله باشد که می تواند باعث رسیدن مواد به زمین شود. و به لایه های زیرزمینی و آبخوان.
استخراج و به دست آوردن لیتیوم
استخراج از مواد معدنی
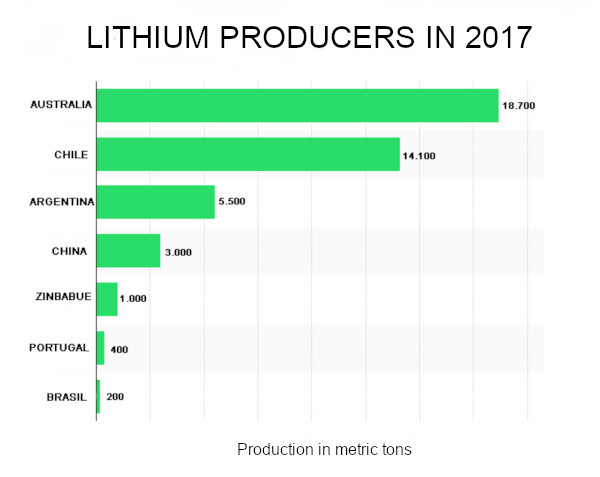
چندین روش استخراج مختلف وجود دارد. استرالیا، بزرگترین تولیدکننده جهانی لیتیوم، آن را از طریق استخراج مرسوم مواد معدنی مانند اسپودومن از گرین بوش به دست می آورد، اما این فرآیند گران و کثیف است.
از سوی دیگر، شیلی، آرژانتین و چین از فرآیند آهسته تبخیر آب شور استفاده می کنند. در مناطقی که در نمکزارهای طبیعی مانند سالار د آتاکاما در شیلی یا در Hombre Muerto و سایرین در آرژانتین وجود دارد، یا از رسوبات از آب نمک استخراج می شود.
بیشتر تولید لیتیوم در جهان از این آب نمک ها حاصل می شود که هزینه تولید آنها بسیار کمتر از ذخایر معدنی است (به گفته جان مک نالتی: به ترتیب 1500-2300 دلار در تن متر و 4200-4500 دلار در تن متر).
ذخایر یا منابع لیتیوم بولیوی در آب نمک است که دارای چگالی تقریبی 1200 گرم در لیتر (گرم در لیتر) است، بنابراین غلظت لیتیوم 0.1 درصد وزنی معادل 1000 قسمت در میلیون (ppm) و 1.2 گرم در لیتر خواهد بود. .
استخراج آب نمک لیتیومی با پمپاژ و تغلیظ آن از طریق جذب با استفاده از جاذب انتخابی یا تبخیر در استخرهای کم عمق ساخته شده برای این منظور انجام می شود.
تبخیر، علاوه بر افزایش غلظت نمک ها، باعث می شود که برخی از این نمک ها در هنگام اشباع رسوب کنند. جذب این مزایا را دارد که تحت تأثیر ترکیب آب شور قرار نمی گیرد (آب نمک هایی با غلظت کم لیتیوم را می توان درست مانند آزمایشات با آب دریا درمان کرد) و همچنین تحت تأثیر شرایط آب و هوایی محل قرار نمی گیرد و ضایعات زیادی تولید نمی شود.
معایب آن این است که معرف ها ضروری هستند. تجهیزات جذب گران و پیچیده است و هزینه جاذب بالا است. مزایای تبخیر طبیعی اساساً این است که انرژی مصرف نمی شود و از معرف های شیمیایی زیادی استفاده نمی شود، در حالی که معایب آن نیاز به استفاده همزمان از روش دیگری برای جداسازی، تجمع زباله و وابستگی به شرایط آب و هوایی محلی (نرخ تبخیر و بارندگی) است. ).
بزرگترین تولید لیتیوم جهان از آب نمک از سالار د آتاکاما در شیلی به دست می آید، جایی که از روش تبخیر استفاده می شود و از آن داده ها و بسیاری از عوامل عملیاتی امکان مقایسه با سالار د اویونی در بولیوی را فراهم می کند.
آب نمک آتاکاما از نظر لیتیوم (همچنین از نظر پتاسیم و بور) غنی تر از آب نمک Uyuni است، بنابراین نسبت Mg/Li که برای غلظت لیتیوم مضر است به ترتیب 1/6 و 1/19 است.
در حالی که تبخیر و بارندگی در آتاکاما 3200 میلی متر در سال و 10-15 میلی متر در سال است، در اویونی 1500 میلی متر در سال و 200-500 میلی متر در سال است، یعنی در اویونی تبخیر کمتر و بسیار بیشتر است. بارندگی که تبخیر را کمی کند می کند.
در آتاکاما، فرآیند تبخیر که لیتیوم را از 0.15٪ تا 6٪ (40 بار) غلیظ می کند از 12 تا 18 ماه طول می کشد. انتظار می رود که این روند در Uyuni بسیار طولانی تر باشد.
مطالعه آزمایشگاهی “تصفیه شیمیایی آب نمک از سالار د اویونی-پوتوسی” که در سال 1987 در فرانسه توسط UMSA-ORSTOM (موسسه تحقیقات علمی فرانسوی برای توسعه) انجام شد، با شبیه سازی شرایط استخرهای تبخیر در 5 ظرف، نشان داد که سدیم کلرید (NaCl) ابتدا تقریباً بلافاصله و سپس کلرید پتاسیم (KCl) رسوب می کند.
از آنجایی که کلرید منیزیم (MgCl 2 ) را نمی توان با تبخیر جدا کرد که این فرآیند را پیچیده می کند، با افزودن آهک به صورت هیدروکسید منیزیم (Mg(OH) 2 ) رسوب می کند.
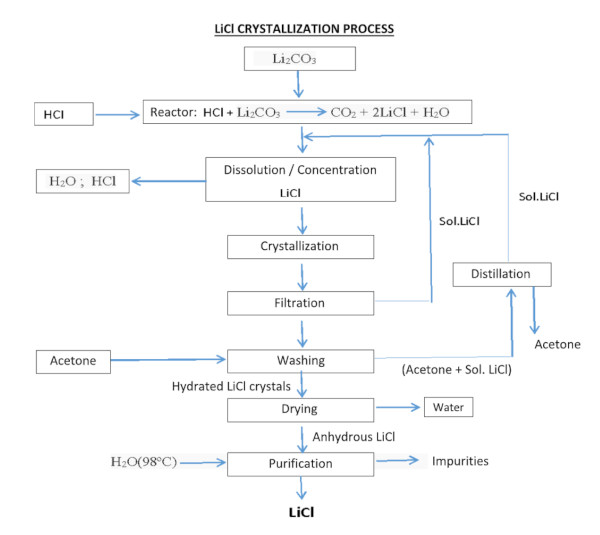
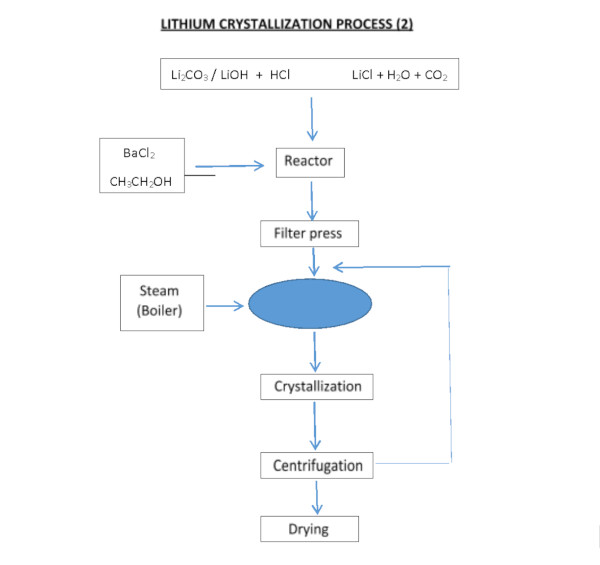
فرآیند به دست آوردن کلرید لیتیوم، از کربنات یا هیدروکسید لیتیم، می تواند با واکنش با اسید کلریدریک به دست آید:
Li 2 CO 3 + 2HCl === 2LiCl + H 2 0 + C0 2
LiOH·H 2 O + HCl === LiCl + 2H 2 O
رسوب و پالایش کربنات لیتیوم (LC)
LC به دست آمده با هر روشی باید خالص، خشک و متبلور شود. علیرغم محتوای بالای لیتیوم در سالار د آتاکاما و تجربه بدست آوردن آن، بازیابی آن 42 درصد است.
LC مورد استفاده در ساخت باتری های وسایل نقلیه الکتریکی باید حداقل 99.95 درصد خلوص داشته باشد، بنابراین LC به دست آمده از رسوب باید از طریق واکنش های مختلف و مراحل تبلور مجدد، در برخی موارد توسط رزین تبادل یونی تصفیه شود.
از آنجایی که فرآیند پالایش هزینه بالایی دارد و بازیابی آن پس از هر مرحله کمتر است (در مرحله پالایش تقریباً 70٪ تخمین زده می شود)، هرچه خلوص LC بالاتر باشد، قیمت آن به نسبت بیشتری افزایش می یابد.
بازیافت باتری ها و بازیابی لیتیوم
با آگاهی از نیاز به بازیافت لیتیوم از باتری های مستعمل و با توجه به کمبود آتی و افزایش هزینه آن، فرآیندهای مختلفی مورد مطالعه قرار گرفته است که در زیر آمده است:
فرآیند فیزیکی – شیمیایی
بازیابی مواد تشکیل دهنده باتری های لیتیوم یونی از طریق فرآیند لیچینگ انجام می شود. یعنی از طریق استفاده از اسیدها برای حل کردن اجزا پس از جدا شدن دستگاه.
کل فرآیند باید یک سری مراحل را دنبال کند که با جمع آوری باتری ها، طبقه بندی و تخلیه برق شروع می شود. سپس جداسازی اجزای آن انجام میشود تا آند و کاتد (قسمتی که امکان واکنش الکتروشیمیایی را فراهم میکنند) کاملاً از هم جدا شوند.
به این ترتیب هر قسمت به طور جداگانه برای بازیابی مواد اولیه باتری مورد استفاده قرار می گیرد.
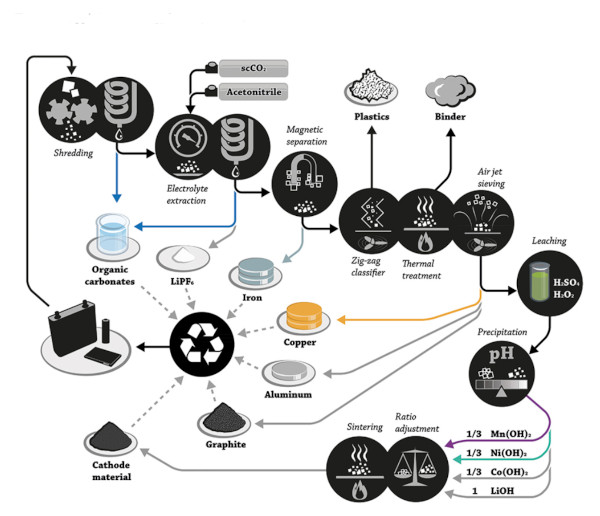
سیستم دیگری جایگزینی برای بازیابی لیتیوم، کبالت، منگنز و نیکل از باتری های استفاده شده تلفن های همراه و رایانه ها ارائه می دهد.
این فرآیند با جداسازی دستی اینها برای جداسازی باقیمانده های مورد نظر آغاز می شود، سپس کاهش اندازه انجام می شود و به ترتیب بین 560 تا 800 میکرومتر از ضایعات دستگاه ها می رسد.
آلومینیوم و مس با هیدروکسید آمونیوم شسته می شوند تا واکنش های تداخلی در مراحل بعدی حذف شوند.
شستشوی فیلتر شده از مرحله قبل با اسید سولفوریک شسته میشود و حداکثر بازیابی 96.0 و 99.9 درصد لیتیوم، کبالت، منگنز، نیکل با غلظتهای 3.0 و 4.0 مولار در هر نوع باقیمانده به دست میآید.
کوکتل اسید شسته شده با هیدروکسید سدیم خنثی می شود، بی کربنات سدیم اضافه می شود و کربنات منگنز، هیدروکسید کبالت و بی کربنات لیتیوم با شرایط لازم مربوطه رسوب می کنند.
سپس تبلور تبخیر محصولات رسوب داده شده انجام می شود و بازیابی بیش از 96.0٪ در هر فلز به دست می آید.
کربنات لیتیوم (Li 2 CO 3 ) رایج ترین ترکیب لیتیوم مورد استفاده است. یک گرم لیتیوم برابر با 5.32 گرم لیتیوم کربنات (CL) است.
بازیابی الکتروشیمیایی لیتیوم
به تازگی، محقق آرژانتینی، ارنستو کالوو، اجرای یک فناوری نوآورانه استخراج لیتیوم در مقیاس بزرگ، بدون تولید زبالههای آلاینده را پیشنهاد کرده است. برای انجام این کار، آب نمک با استفاده از یک سیستم پمپاژ به منظور قرار دادن یک راکتور با دو الکترود استخراج می شود.
اینها از یک سو یونهای لیتیوم و از سوی دیگر کلرید آب نمک را به دام می اندازند تا به سطح نمک بازگردانده شوند. متعاقباً قطبیت الکتریکی راکتور معکوس شده و فرآیند معکوس انجام می شود، یعنی آب نمک حذف می شود و محلول بازیافتی اضافه می شود که کلرید لیتیوم را غلیظ می کند.
برای این فرآیند از انرژی خورشیدی استفاده می شود و کلرید لیتیوم استخراج شده از آب نمک نوعی باتری لیتیومی برای ذخیره انرژی های تجدیدپذیر متناوب را تشکیل می دهد.
غشاهای اسمز معکوس قادر به جداسازی لیتیوم هستند
اخیراً فناوری جدیدی توسعه یافته است که به لیتیوم اجازه می دهد تا از آب دریا خارج شود و این کار را به طور مؤثر انجام دهد و همچنین در این فرآیند آب آشامیدنی تولید کند.
همانطور که می دانیم، آب دریا یک کوکتل پیچیده از مواد معدنی مفید است، اما جدا کردن آنهایی که نیاز داریم، مانند لیتیوم، دشوار است. تیمی از دانشمندان از استرالیا و ایالات متحده یک روش جدید شیرین سازی آب را توسعه داده اند که نه تنها می تواند آب دریا را قابل شرب کند، بلکه لیتیوم موجود در آن را نیز بازیابی می کند.
کلید این فرآیند ساختارهای فلزی-آلی (MOF) است که دارای بیشترین سطح داخلی در بین مواد شناخته شده است. یک گرم از نظر تئوری می تواند یک زمین فوتبال را پوشش دهد، و این ساختار درونی پیچیده است که آنها را برای گرفتن، ذخیره و رهاسازی مولکول ها عالی می کند.
در حال حاضر، غشاهای اسمز معکوس متداول ترین فناوری مورد استفاده برای تصفیه آب هستند و به روشی نسبتاً ساده کار می کنند.
منافذ غشاء به اندازه کافی بزرگ هستند که مولکول های آب از آن عبور کنند، اما برای اکثر آلاینده ها بسیار کوچک هستند. مشکل این است که برای کار کردن، این سیستم ها نیاز به پمپاژ آب با فشار نسبتا بالا دارند.
از طرف دیگر غشاهای MOF می توانند انتخابی تر و کارآمدتر باشند.
محققان دانشگاه موناش، سازمان تحقیقات علمی و صنعتی مشترک المنافع و دانشگاه تگزاس چنین غشایی را ساخته اند.
این طرح از “انتخاب پذیری یونی” غشای سلولی بیولوژیکی الهام گرفته شده است، که به ماده MOF اجازه می دهد تا یون های خاصی را هنگام عبور از خود آبگیری کند. بهتر از آن، این فیلترها برای تشکیل نیازی به آب ندارند، که در مصرف انرژی نیز صرفه جویی می کند.
Huanting Wang، نویسنده این مطالعه جدید می گوید: «ما می توانیم از یافته های خود برای مقابله با چالش های نمک زدایی آب استفاده کنیم. این تحقیق به جای تکیه بر فرآیندهای گران قیمت و مصرف بالای انرژی در حال حاضر، راه را برای حذف یونهای نمک از آب به روشی بسیار کارآمدتر از نظر انرژی و پایداری محیطی باز میکند.
این یونهای لیتیوم در آب دریا به وفور یافت میشوند (تقریباً 0.17 ppm)، بنابراین توسعه این فناوری میتواند پیامدهای زیادی برای صنعت معدن داشته باشد که در حال حاضر از درمانهای شیمیایی و ناکارآمد برای استخراج لیتیوم از سنگها و نمکها استفاده میکند.
تقاضای جهانی برای لیتیوم مورد نیاز برای بخش هایی مانند صنعت خودروهای الکتریکی به طور فزاینده ای بالا است، بنابراین این غشاها به عنوان جایگزینی کارآمد برای استخراج لیتیوم خود از آب دریا، که یک منبع فراوان و به راحتی قابل دسترسی است، قرار می گیرند.
بنابراین بهره برداری از آن نیز باید اقتصادی باشد. در این نرم افزار ما می توانیم به اسمز معکوس از نوع بسته فکر کنیم تا غلظت لیتیوم را به حداکثر برسانیم و در نتیجه اندازه و هزینه سیستم تبلور تبخیر و تبلور بعدی را کاهش دهیم.
بازیابی تبخیری انتخابی لیتیوم (LiOH)
بازیابی انتخابی لیتیوم از آب نمک با محتوای کمتر از 1٪ در حضور غلظت های بالای سایر یون های قلیایی و قلیایی خاکی یک هدف صنعتی است.
فرآیندهای تبخیری بر اساس حلالیت تفاضلی نمک های لیتیوم در محلول های غلیظ آب نمک است که به آن تبلور مجدد کسری می گویند. روش دیگر، فرآیندهای شیمیایی و الکتروشیمیایی انتخابی برای بازیابی کلرید لیتیوم، هیدروکسید لیتیوم یا کربنات لیتیوم با خلوص بالا طراحی شده اند که به دنبال کاهش زمان فرآیند و کاهش اثرات زیست محیطی به دلیل از دست دادن آب و تشکیل زباله های مضر برای محیط زیست هستند.
اخیراً یک روش سریع بر اساس رسوب لیتیوم فسفات کم محلول، Li 3 PO 4 (0.39 گرم در لیتر) برای تصفیه آب نمک با اسید فسفریک پیشنهاد شده است:
3Li 3 PO 4 + 5Ca(OH) 2 → Ca 5 (PO 4 ) 3.OH + 9LiOH
سپس لیتیوم فسفات نامحلول با آهک تصفیه می شود تا هیدروکسی آپاتیت بسیار نامحلول تشکیل شود و هیدروکسید لیتیوم محلول بازیابی شود.
فرآیندهای استخراج لیتیوم از معادن نمک آرژانتین در این فرآیند اسید فسفریک با تصفیه هیدروکسی آپاتیت با اسید سولفوریک، با تشکیل سولفات کلسیم هیدراته (گچ) که کاربردهای ساختمانی دارد، بازیابی می شود:
Ca 5 (PO 4 ) 3.OH + 5H 2 SO 4 → 5CaSO 4 .2H 2 O + H 3 PO 4
این روش توسط شرکت فولاد کره ای Posco ثبت شده است که در سال 2015 یک کارخانه آزمایشی را در Cachauri، Jujuy نصب کرد. این روش آب نمک را از طریق تبخیر پردازش نمی کند، بنابراین به طور قابل توجهی سریعتر از روش های تبخیری است.
با این حال، به دلیل استفاده از اسید فسفریک، که اگرچه بازیافت شده است، می تواند بقایای منیزیم و فسفات کلسیم را به شکل لجن آلوده به جا بگذارد.
روش های جذب
جذب انتخابی لیتیوم موجود در آب نمک (300-1000 ppm) و آب دریا (0.125ppm) به طور گسترده با استفاده از جاذب هایی مانند MnO 2 ، TiO 2 ، هیدروکسید آلومینیوم و غیره مورد مطالعه قرار گرفته است.
جذب لیتیوم در این سیستمها بستگی به درهمآمیزی یونهای لیتیوم در شبکههای غیر استوکیومتری این اکسیدها با ظرفیتی دارد که با نوع جاذبها در mg/g 35-3 تغییر میکند.
هنگام استخراج محلول های غنی از یون لیتیوم مانند آب نمک (> 5 میلی گرم در لیتر)، می توان به جذب بیش از 20 میلی گرم در گرم دست یافت.
نتیجه گیری
سطح فعلی بازیافت باتریهای لیتیوم یونی هنوز محدود است، زیر 1٪ و شرکتهای کمی در زنجیره تامین در اروپا وجود دارند که فعالانه در بازیابی فلزات استراتژیک موجود در باتریها مشارکت دارند.
آیا تولیدکنندگان باید مسئول هزینه بازیافت لیتیوم باشند؟ یا آیا ما مصرف کنندگان باید کسانی باشیم که برای آن هزینه زیست محیطی بپردازیم؟
پاسخ هرچه که باشد، آنچه مشهود است این است که تکنیک های بازیافت این مواد باید کامل شود تا جایی که سودآوری داشته باشد و کمترین تأثیر را بر محیط زیست داشته باشد.
ما به سمت دنیایی با کمبود روزافزون منابع طبیعی حرکت می کنیم، اگر منابعی را که برایمان مفید است نیز هدر دهیم، نقطه ای فرا می رسد که ممکن است در دسترس نباشند.
اگر اکنون شکایت کنیم که باتری ها با لیتیوم فراوان گران هستند، چه اتفاقی می افتد اگر این فلز شروع به تمام شدن کند زیرا آن را در بتن دفن کرده ایم؟
دیدگاهتان را بنویسید